207-表观遗传相关名词解释
刘小泽写于2020.09.23 RNA转录水平至多能够解释细胞中功能蛋白丰度的50%,而转录后基因调控提供了更多精细调节的选择
关于组蛋白修饰
https://www.abcam.cn/epigenetics/histone-modifications-a-guide
组蛋白修饰与基因表达联系
可将基因组调节成易于 DNA 转录的常染色体活性区域或者 DNA 更紧密,不易于转录的失活异染色质区域,借此调控基因表达
什么是组蛋白修饰
组蛋白将 DNA 组装并排列成称为核小体的结构,使其适于存储在细胞核中。每个核小体含有两个亚基,两个亚基均由组蛋白 H2A、H2B、H3 和 H4(称之为核心组蛋白)构成,而连接组蛋白 H1 则作为稳定剂
组蛋白 H3 是修饰最多的组蛋白,组蛋白 H3 的修饰能预测染色质的类型(异染色质或常染色质)、区分基因组功能元件(启动子、增强子、基因主体)以及检测决定这些元件处于活性状态或是抑制状态。研究组蛋白 H3 的修饰时,最有用的对照是总组蛋白 H3。
组蛋白甲基化
H3 和 H4 的赖氨酸甲基化可调节转录激活和抑制,而精氨酸甲基化则促进转录激活
赖氨酸可被单甲基化、二甲基化或三甲基化
- K4 的单或三甲基化(H3K4me1 或 H3K4me3)均为激活标记(H3K4me1 存在于转录增强子中,而 H3K4me3 存在于基因启动子中)
- K36 的三甲基化 (H3K36me3) 与基因主体的转录区域相关
- K9 和 K27 的三甲基化(H3K27me3 和 H3K9me3)都是抑制信号( H3K27me3 是控制发育调控因子的临时信号,主要存在于基因密集区域的启动子中,并与胚胎干细胞中的发育调控因子,包括 Hox 和 Sox 基因密切相关;H3K9me3 则是具有串联重复结构的染色体区域形成永久异染色质的信号,通常存在于缺少基因的区域例如卫星重复、端粒和近着丝粒区,也标记反转录转座子和锌指基因中的某些特定家族 KRAB-ZFP)。它们都存在于失活的 X 染色体中,H3K27me3 位于基因间区域和沉默的编码区,而 H3K9me3 主要出现在活性基因的编码区中
组蛋白乙酰化
通常与开放染色质结构相关,主要出现在启动子区域
- 组蛋白 H3 的 K9 和 K27 乙酰化(H3K9ac 和 H3K27ac)通常与活性基因的增强子和启动子有关
组蛋白磷酸化
核心组蛋白的磷酸化是细胞分裂中染色体凝缩、转录调控和 DNA 损伤修复的关键中间步骤。与乙酰化和甲基化不同,组蛋白磷酸化似乎需要通过与其他组蛋白修饰的相互作用并作为效应子蛋白的平台,才可发挥其功能。
组蛋白 H3 的 S10 磷酸化(S10 磷酸化 H3)和组蛋白 2A 的 T120 的磷酸化是有丝分裂的标志
H2AX 的 S139 磷酸化(形成 γH2AX)被认定为 DNA 双链断裂后最早发生的的事件之一,并作为 DNA 损伤修复蛋白的聚集点
H2B 磷酸化可促进细胞凋亡相关的染色质凝缩、DNA 片段化和细胞死亡
组蛋白泛素化
组蛋白 H2A 和 H2B 是细胞核中泛素化程度最高的两种蛋白。
- 最常见的形式是 H2A 的 K119 单泛素化以及 H2B 的 K123(酵母)/K120(脊椎动物)单泛素化
- 还也发现了多泛素化的组蛋白,例如 H2A 和 H2AX 的 K63 多泛素化
- H2A 的单泛素化由多梳类蛋白催化,且大部分与基因沉默有关
- H2B 与转录激活有关
- H2A 和 H2B 的单泛素化是可逆的,并由组蛋白泛素连接酶和去泛素化的酶严密调控
- 组蛋白 H2A、H2B 和 H2AX 的单泛素化也发生在 DNA 双链的断裂位点
修饰标记
修饰标记在经历多次细胞分裂后依然能保持稳定,这一过程是高度动态的,并且由一组特定的酶调控。
- 修饰蛋白:向组蛋白添加表观遗传学标记。如组蛋白乙酰转移酶 (HAT)、组蛋白甲基转移酶 (HMT/KMT)、蛋白精氨酸甲基转移酶 (PRMT) 以及激酶等酶
- 识别蛋白:识别并结合由修饰蛋白建立的表观遗传学标记,从而确定其功能。如布罗莫结构域、染色质域和 Tudor 域的蛋白
- 去修饰蛋白:催化表观遗传学标记的去除。如组蛋白去乙酰化酶 (HDAC)、赖氨酸去甲基化酶 (KDM) 和磷酸酶
最方便记忆的组蛋白修饰
- Active promoters: H3K4me3, H3K9Ac
- Active enhancers: H3K27Ac, H3K4me1
- Repressors: H3K9me3, H3K27me3
- Transcribed gene bodies: H3K36me3
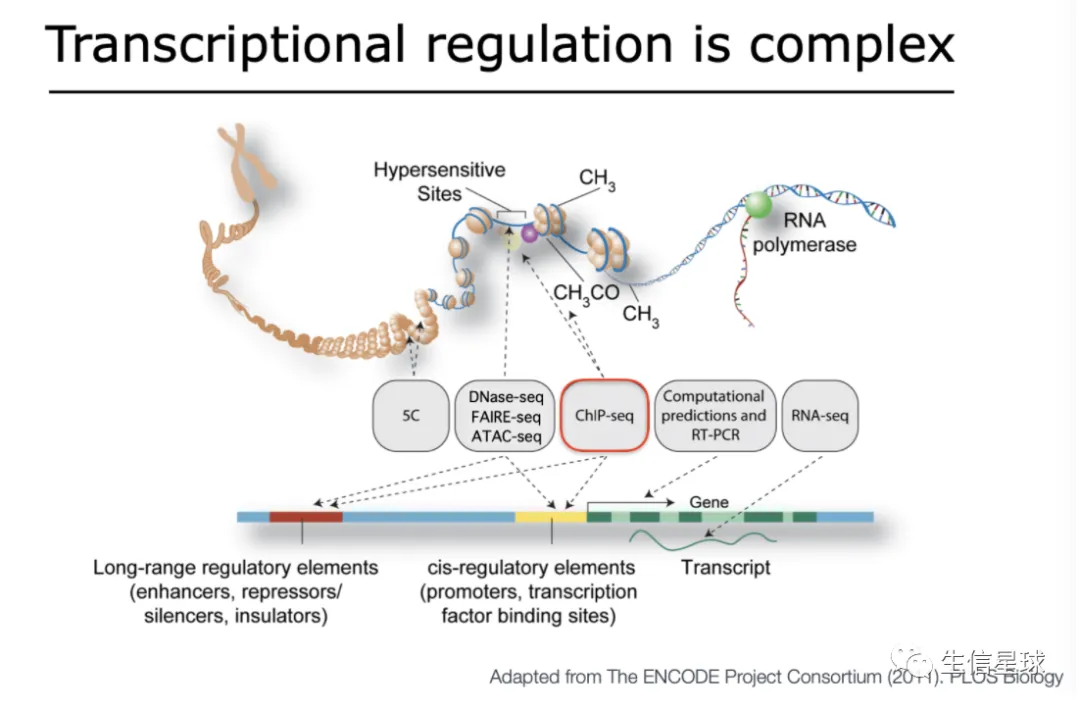
顺式作用元件与反式作用因子
转录后调控多含了多种生物学进程,例如RNA剪接、polyA加尾(RNA多聚腺苷酸加尾),RNA降解及mRNA翻译等等。尽管这些不同进程的具体作用分子机制各有不同,但总体而言,它们的调控都是由位于RNA上的顺式调控元件(cis-regulatory elements)和以RNA结合蛋白为代表的反式因子(trans-regulatory elements)相互作用完成
真核细胞基因由编码蛋白质的编码区和具有调控作用的非编码区组成。其中,编码区由外显子和内含子间隔排列,而非编码区,又称“侧翼序列”,特指第一个外显子和最末一个外显子的外侧区域,包含有启动子、终止子、上游启动子元件、增强子、沉默子、反式作用因子等元件。
顺式作用元件定义
顺式作用元件(cis-acting element 或者 cis-regulatory modules, CRMs)是存在于基因旁侧序列中,能影响基因表达的DNA序列;顺式作用元件本身不编码任何蛋白质,仅仅提供一个结合位点,要与反式作用因子(多是转录因子)结合后来改变结合位点的特性。调控方式包括对基因转录可变剪切的调控、转录起始位点的调控以及转录效率的调控。
顺式作用元件分类
按功能分为
通用调节元件
启动子:RNA 聚合酶结合并启动转录的 DNA 序列;单靠 RNA 聚合酶难以结合 DNA 而启动转录,而是需要多种蛋白质因子的相互协调作用
增强子(enhancer):位于结构基因附近,能够增强该基因转录活性的一段DNA序列
enhancer的paper: Transcriptional enhancers: from properties to genome-wide predictions
终止子(terminator):位于基因编码区下游,能够终止RNA转录合成的特殊DNA序列
沉默子(silencer):位于结构基因附近,能抑制该基因转录表达;是一种负性调控元件,其作用特征与增强子类似,在组织细胞特异性或发育阶段特异性的基因转录调控中起重要作用
绝缘子/隔绝子(insulator):通常位于启动子同正调控元件(增强子)或负调控因子之间,具有转录活性结构域的边界DNA序列,能够阻止邻近的增强子或沉默子对其界定的基因的启动子发挥调控作用;绝缘子的抑制作用具有方向性
专一性元件
- 热激应答元件
- 金属应答元件
- 激素反应元件
- cAMP反应元件
- …
反式作用因子定义
反式作用因子(trans-acting factor)是指通过直接结合或间接作用于DNA、RNA等核酸分子,对基因表达发挥不同调节作用(激活或抑制)的各类蛋白质。它本身对基因表达没有调控作用,只是阻断来自上、下游的调控效应;主要指能结合在基因序列上的特异性蛋白质──转录因子。当然除了蛋白,某些DNA,RNA片断也具有类似的调控功能,因此反式作用因子不仅仅是转录因子
关于转录因子
定义可见:https://www.nature.com/scitable/definition/transcription-factor-167/
真核基因的转录调节蛋白称为转录因子。RNA 聚合酶是一种反式作用于转录的蛋白因子,通常不能单独发挥转录作用,而需要与其他转录因子共同协作。
- 通用转录因子:RNA 聚合酶介导基因转录时所必需的一类辅助蛋白质,帮助聚合酶与启动子结合并起始转录,对所有基因都是必需的
- 特异转录因子:个别基因转录所必需,分为转录激活因子和转录抑制因子。转录激活因子多是增强子结合蛋白;转录抑制因子多是沉默子结合蛋白;与启动子上游元件,如 GC 盒、CAAT 盒等顺式作用元件,结合的蛋白质称为上游因子;与增强子等远端调控序列结合的转录因子称为可诱导因子
转录因子结构特点
- 至少包括两个结构域:DNA 结合域包括锌指模体结构、碱性螺旋-环-螺旋结构、碱性亮氨酸拉链模体结构;转录激活域分为酸性激活结构域、谷氨酰胺富含结构域、脯氨酸富含结构域
- 包含一个介导蛋白:最常见的是二聚化结构域
- 转录因子(TF)的结合位点一般应该分布在基因的前端。但是新的研究发现,人的21和22号染色体上,只有22%的转录因子结合位点分布在蛋白编码基因的5’端
研究技术
ChIP、RIP、RNA pull-down、EMSA、Luciferase是基因表达调控研究中,最为核心、最为关键的实验技术。
对于已知或候选反式因子(表观和转录因子)和顺式因子的研究手段较成熟,比如经典的EMSA,报告基因,ChIP等。
顺式调控元件(TRE)和反式调控元件(CRE)一直是人们感兴趣的对象,通常利用染色质免疫沉淀(ChIP)和染色质捕获技术来研究。不过,德克萨斯大学西南医学中心的研究人员最近开发出一种新方法(CAPTURE),结合CRISPR的靶定能力以及生物素-链霉亲和素的互作优势来鉴定TRE和CRE。
CAPTURE包括三个关键的组分:
- 带有生物素接受位点的dCas9;
- 生物素连接酶BirA,它将生物素添加到接受位点;
- 将生物素化的dCas9引到目的位点的gRNA。靶定之后,通过甲醛交联来固定蛋白与DNA相互作用
仍存在一些不足,比如需要的细胞样本量较大,每次实验需0.25~1 ×109个细胞
原文:Liu, et al. In Situ Capture of Chromatin Interactions by Biotinylated dCas9. Cell 170, 1028–1043 (2017).
蛋白质相互作用高通量筛选新系统。
CRISPR单向导RNA(SgRNA)文库筛选增强子
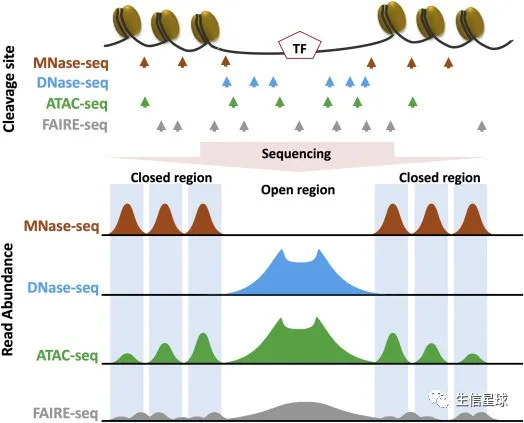
研究调控元件,除了ChIP-Seq,还有很多其他测序技术:DNase-Seq、ATAC-Seq、ChIA-PET、3C等
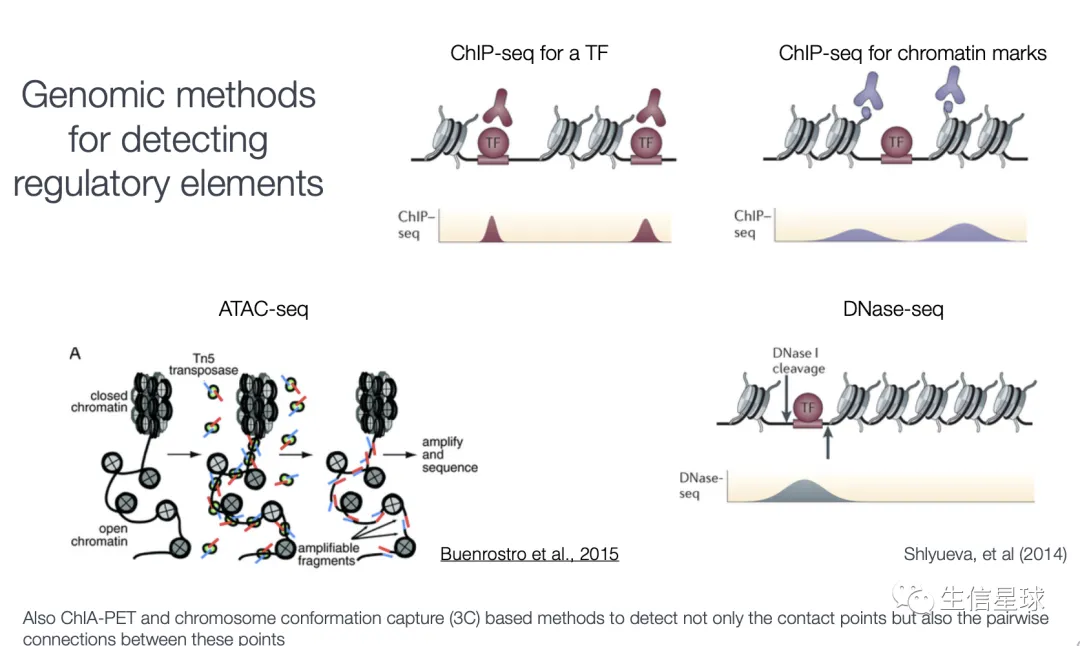
来自: Chapter 4 - Bioinformatics of Epigenomic Data Generated From Next-Generation Sequencing